Mga Paksa:
- Panimula
- Pabilog na proseso
- Log ph chart
- Ihambing ang R134a sa R1234yf
Panimula:
Ang proseso ng paglamig sa air conditioning ng kotse ay gumagamit ng mga pagbabago sa estado ng isang substance. Sa panahon ng pagbabago ng estado, tulad ng paglipat mula sa likido patungo sa singaw, nagbabago ang istruktura ng molekular ng sangkap, na nangangailangan ng init. Ang init ay nasisipsip kapag ang likido ay nagbabago sa singaw, at sa kabaligtaran na kaso, kapag lumilipat mula sa singaw patungo sa likido, ang init ay inilabas.
Kung titingnan natin ang paglipat ng init papunta at mula sa kapaligiran, makikita natin na sa panahon ng proseso ng evaporation ang kapaligiran ay lumalamig, habang ang init ay inilalabas at ang kapaligiran ay umiinit sa panahon ng condensation. Ang paglamig na ito ng kapaligiran ay nangyayari sa evaporator, habang ang pag-init ay nagaganap sa condenser. Ang prosesong ito ay paulit-ulit, kung kaya't ito ay kilala bilang isang pabilog na proseso.
Sa pahina ng "Pagpapakilala ng air conditioning", ang proseso ng pag-ikot kasama ang iba't ibang bahagi ng air conditioning ay inilarawan sa praktikal na paraan. Sa pahinang ito ay susuriin pa natin ang proseso ng pag-ikot na ito sa pamamagitan ng log pH diagram.
Proseso ng pag-recycle:
Bago tayo magpakita ng buong log pH chart, magsimula tayo sa proseso ng air conditioning cycle. Sa proseso ng cycle na ito ginagamit namin ang diagram ng nagpapalamig na R134a. Sa diagram na ito ang mga lugar para sa gas, gas-liquid at likido ay nakikilala sa bawat isa. Ang kritikal na punto ay nasa tuktok, sa 101 degrees Celsius at isang presyon ng 40 bar. Ito ang pinakamataas na temperatura at presyon kung saan ang nagpapalamig ay chemically stable. Ang nilalaman ng init (enthalpy) ay naka-plot laban sa presyon sa x-axis. Bagama't madalas nating tinutukoy ito bilang isang "pH chart," ito ay talagang isang "log-pH chart" dahil sa logarithmic scaling.
- Sa punto 1 sa diagram magsisimula ang compressor, na kumukuha ng nagpapalamig mula sa evaporator. Ang presyon ay 2 bar;
- Ang gas ay naka-compress mula 1 hanggang 2, pinatataas ang presyon at nilalaman ng init. Ang presyon at temperatura ay tumaas sa 15 bar at 70 degrees Celsius. Ang gas ay sobrang init;
- Dahil sa paglabas ng init sa condenser, bumababa ang nilalaman ng init at samakatuwid ay ang temperatura sa simula. Ang gas ay nawawala ang sobrang init nito sa pagitan ng mga punto 2 at 3, na nagiging sanhi ng pagbaba ng temperatura mula 70 hanggang 55 ° C.
- Mula sa punto 3 hanggang 4 mayroong paglabas ng init sa isang pare-parehong temperatura. Dito ang gas ay na-convert sa likido. Ang presyon ay nananatiling pare-pareho;
- Ang karagdagang paglamig ay nagiging sanhi ng bahagyang paglamig ng likido (mula 4 hanggang 5). Ang supercooled na likido sa ilalim ng mataas na presyon ng 15 bar ay umabot sa isang constriction sa punto 5: ang capillary o expansion valve. Dito ang mataas na presyon ay pinaghihiwalay mula sa mababang presyon. Mula sa compressor maaari din nating sabihin na ang discharge pressure ay hiwalay sa suction pressure.
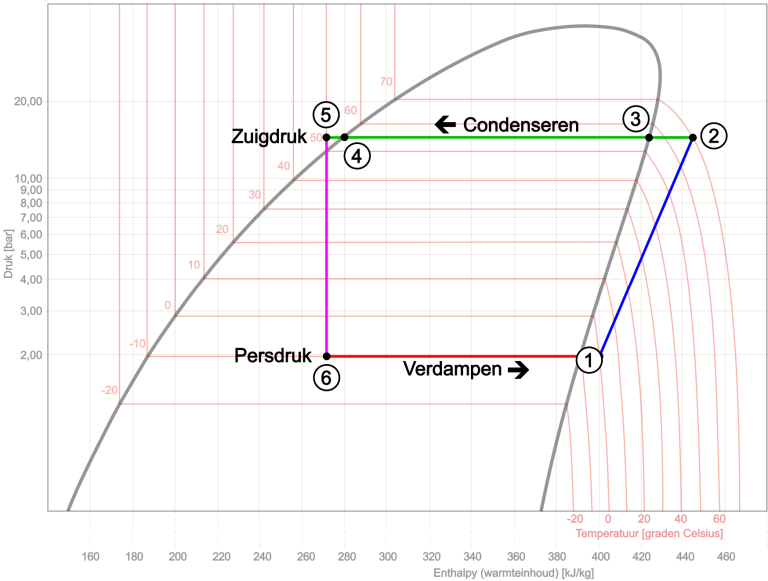
Dahil sa biglaang pagbaba ng pressure sa constriction, bababa ang boiling point ng refrigerant sa liquid phase, na nagiging sanhi ng spontaneous evaporation. Ang init na kinakailangan para dito ay unang kinuha mula sa nagpapalamig mismo at sa paligid nito. Ito ay nananatili ang nilalaman ng init ay halos pare-pareho. Ang kumpletong pagsingaw pagkatapos ay magaganap sa evaporator mula sa punto 6 hanggang 1. Ang kumukulong temperatura ng nagpapalamig ay bumaba sa pagitan ng mga punto 5 at 6 ng 50° C hanggang -10°C, sa kalaunan ay umiinit hanggang sa punto 1 bilang isang gas sa 0°C. Ang init na nilalaman ng nagpapalamig ay tumataas, kasama ang kinakailangang init na nakuha mula sa kapaligiran, sa kasong ito ang hangin na dumadaan sa evaporator. Ang presyon at temperatura ay nananatiling halos pare-pareho. Ang nagpapalamig ay umalis sa evaporator bilang singaw at sinipsip muli ng compressor sa punto 1. Ang proseso ay umuulit.
Mag-log pH chart:
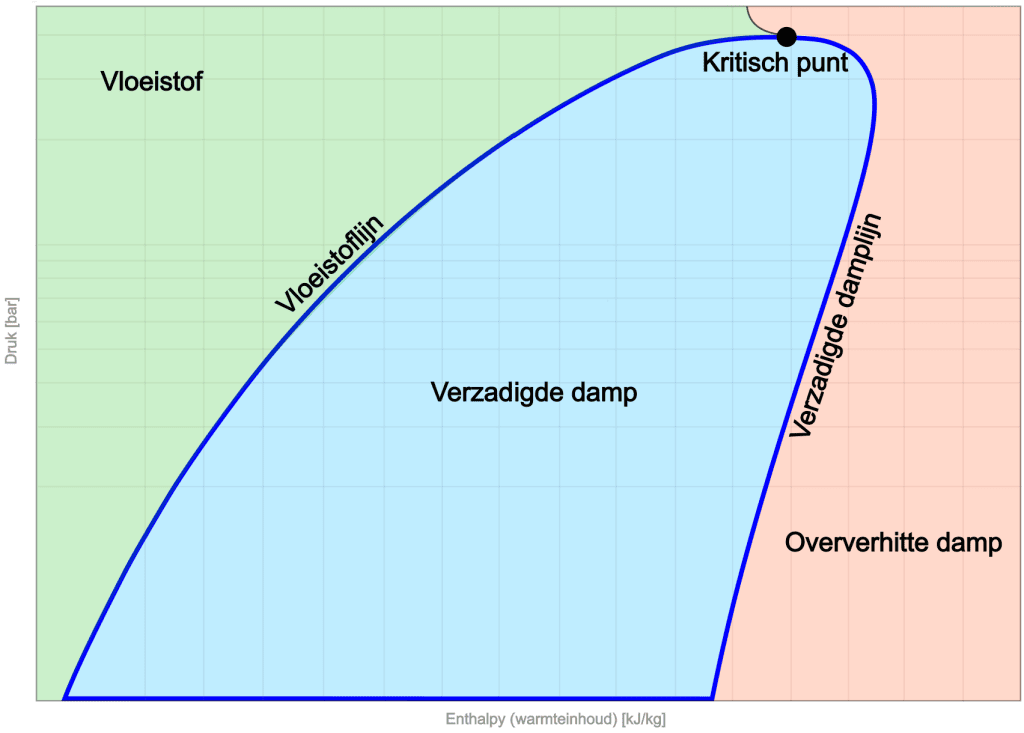
Sa nakaraang seksyon, ipinakita ang log pH diagram na nagpapakita ng proseso ng pag-ikot (mula sa pagsingaw hanggang sa condensation ng nagpapalamig. Ang larawan sa ibaba ay nagpapakita ng kondisyon ng nagpapalamig sa isang tiyak na presyon na may kaugnayan sa enthalpy (nilalaman ng init), kung saan ang proseso ng pagbibisikleta ay ipinahiwatig ng madilim na asul na linya.
Sa kaliwang bahagi ng diagram ay ang lugar ng likido. Sa mababang enthalpy ang nagpapalamig ay nasa likidong anyo. Sa pagtaas ng enthalpy ang linya ng likido ay naabot. Ang slope ng linyang ito ay nagpapahiwatig ng mga pagbabago sa presyon at enthalpy para sa likidong bahagi.
Sa gitna ng diagram ay ang saturated vapor zone. Dito ang nagpapalamig ay nasa thermal equilibrium, na may parehong likido at singaw.
Sa kanan ay makikita natin ang saturated vapor line, na minarkahan ang limitasyon kung saan ang nagpapalamig ay ganap na nag-evaporate at nasa isang superheated vapor phase.
Sa tuktok ng diagram ay ang kritikal na punto, na nagmamarka ng hangganan sa pagitan ng likido at singaw. Dito nawawala ang pagkakaiba sa pagitan ng singaw at likido, na iniiwan ang nagpapalamig sa isang natatanging estado. Walang malinaw na paglipat sa pagitan ng likido at singaw.
Para makapagbigay ng higit pang insight sa log-ph diagram, ilang curve ang idinaragdag sa diagram sa ibaba: ang kalidad ng isentropic, isothermal, isochoric at vapor. Sa pagguhit sa ibaba ay muli nating nakikita ang pabilog na proseso (kulay na kulay abo) kasama ang pag-unlad ng iba pang mga proseso. Narito ang isang maikling paliwanag ng bawat pagbabago ng estado:
Isentropic: ang at isentropic na linya ay nailalarawan sa pamamagitan ng patuloy na entropy. Nangangahulugan ito na sa panahon ng isang proseso kasama ang linyang ito ang nagpapalamig ay walang palitan ng init sa kapaligiran at hindi sumasailalim sa pagbabago ng entropy. Ito ay isang mahusay na linya ng proseso ng adiabatic (walang pagpapalitan ng init) sa diagram.
Isothermal: Ang isang isothermal na linya sa log-pH diagram ay kumakatawan sa isang patuloy na proseso ng temperatura. Sa prosesong ito, ang temperatura ng nagpapalamig ay nananatiling pare-pareho, na nangangahulugan na ang init ay ibinibigay o inalis upang panatilihing pare-pareho ang ratio ng pressure-enthalpy (ph).
Isochore: Ang isang isochoric na linya sa log-pH diagram ay kumakatawan sa isang patuloy na proseso ng dami. Sa prosesong ito, ang tiyak na dami ng nagpapalamig ay nananatiling pare-pareho, ibig sabihin ay walang pagbabago sa volume na nangyayari. Nagbibigay-daan ito sa istilo ng linya na umakyat o pababa sa diagram depende sa iba pang mga pagbabago gaya ng pressure at enthalpy.
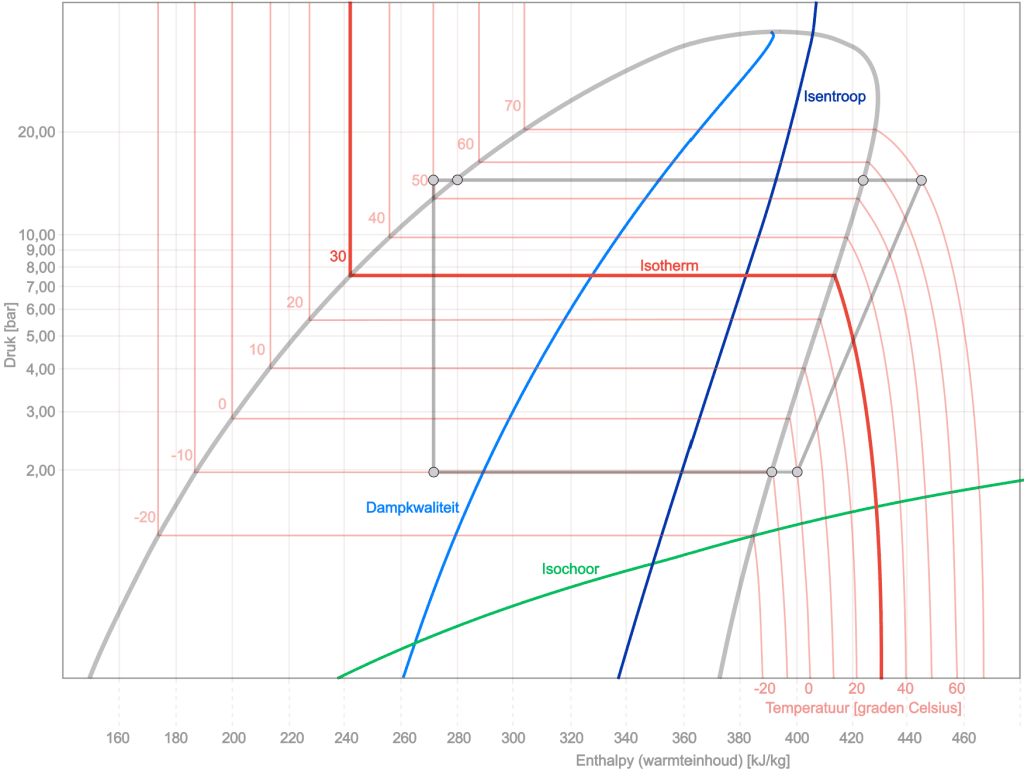
- Kalidad ng singaw: Sa isang chart ng pH ng log ng nagpapalamig, ang x-axis ay nagpapahiwatig ng hanay ng kalidad, mula sa "x=0" (ganap na likido) hanggang sa "x=1" (ganap na gas). Sa pagitan ng mga sukdulang ito, ang nagpapalamig ay nasa isang dalawang-phase na estado, na may halagang x na nagpapahiwatig ng ratio ng gas sa likido. Ang isang linya mula sa "x=0,10" hanggang sa "x=0,90" sa diagram ay nagpapahiwatig na ang nagpapalamig ay nasa loob ng dalawang-phase na hanay na ito, na may partikular na x value na nagpapahiwatig ng gas/liquid partition. Ito ay mahalaga para sa pag-unawa sa pag-uugali ng nagpapalamig sa mga aplikasyon tulad ng mga sistema ng pagpapalamig at air conditioning.
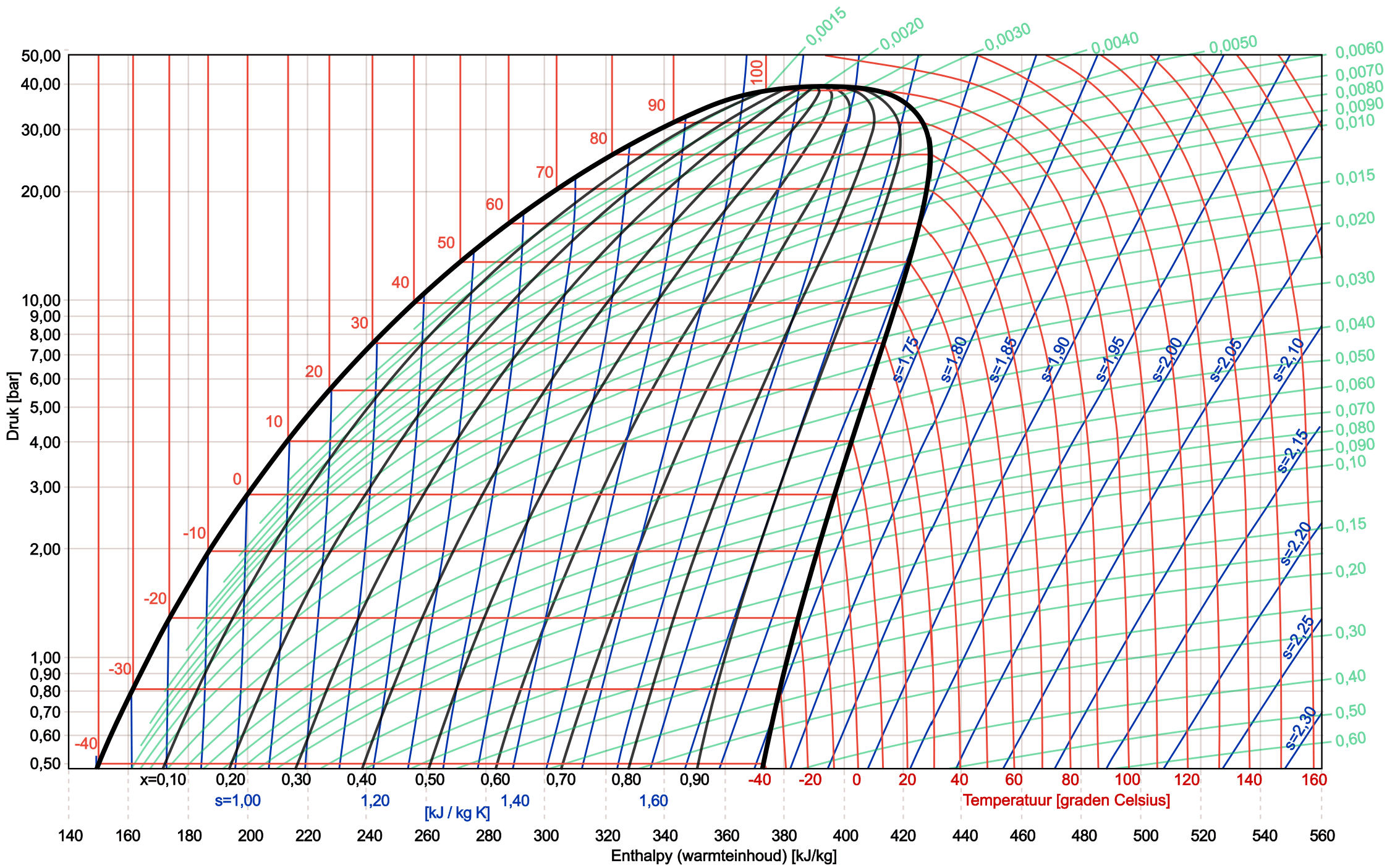
Sa larawan sa ibaba makikita natin ang isang kumpletong log pH diagram ng nagpapalamig na R134a.
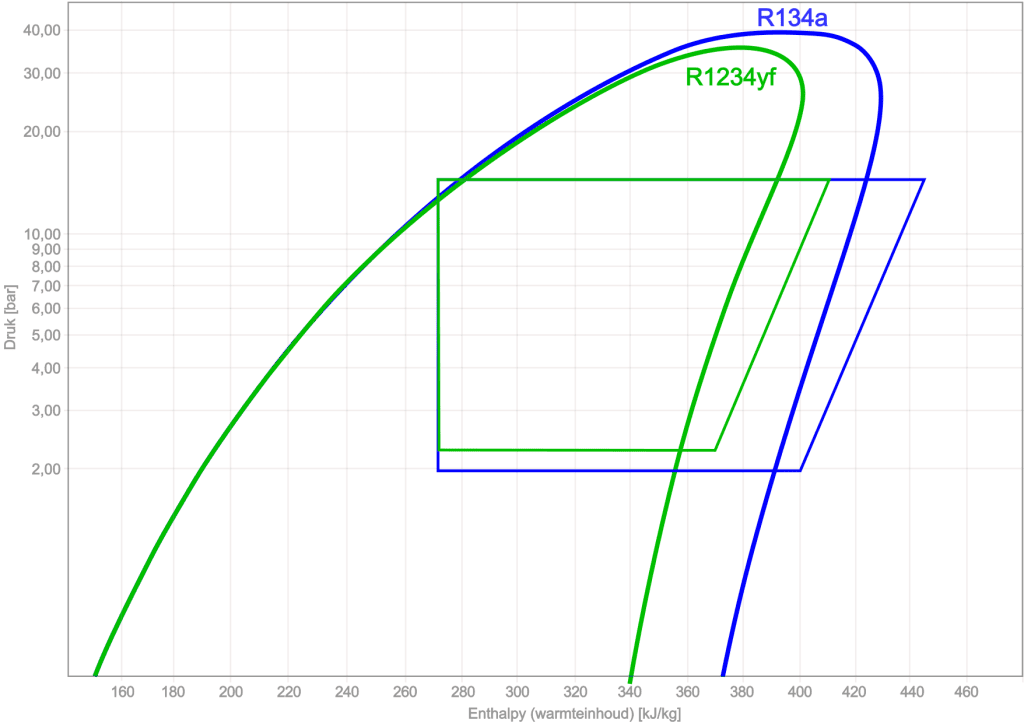
Ihambing ang R134a sa R1234yf:
Gamit ang log pH diagram, maihahambing ang iba't ibang uri ng mga nagpapalamig sa bawat isa. Ang sumusunod na figure ay nagpapakita ng log pH diagram at mga proseso ng pagbibisikleta ng R134a at R1234yf.
Kaugnay na pahina:
