Temos:
- Vandenilis
- Vandenilio gamyba
- Vandenilis kaip kuras Otto varikliui
- Kuro elementas
- Sandėliavimo bakas
- Vandenilio diapazonas ir kaina
Vandenilis:
Vandenilis (anglų kalba vadinamas vandeniliu) gali būti naudojamas kaip energijos nešiklis transporto priemonėms varyti. Energijos nešiklis reiškia, kad energija jau iš anksto įdėta į vandenilį. Tai prieštarauja (iškastiniams) energijos šaltiniams, tokiems kaip nafta, gamtinės dujos ir anglis, kur energija gaunama apdorojant šias medžiagas jas deginant.
Todėl vandenilis yra kažkas visiškai kitokio nei vandens įpurškimas, kuris naudojamas ne kaip energijos nešiklis benzininiuose varikliuose, o tik degimo kamerai vėsinti.
Siekiama, kad naudojant vandenilį būtų pasiekta „nulinė emisija“; energijos forma, kuri naudojimo metu neišskiria kenksmingų dujų. Perėjimas nuo iškastinio kuro prie elektros varymo kartu su vandeniliu ir kuro elementu patenka į energijos perėjimas. Transporto priemones varyti vandeniliu galima dviem skirtingais būdais:
- Vandenilio naudojimas kaip Otto variklio kuras. Vandenilis pakeičia benziną.
- Gaminti elektros energiją naudojant vandenilį kuro elemente. Naudodamas šią elektros energiją, elektros variklis transporto priemonę varys visiškai elektra.
Abu būdai aprašyti šiame puslapyje.
Vandenilis gali būti gaminamas naudojant tvarią energiją arba naudojant iškastinį kurą. Pastarųjų stengiamės kuo labiau užkirsti kelią, nes iškastinio kuro ateityje ims trūkti. CO2 taip pat susidarys perdirbant iškastinį kurą.

Toliau pateiktuose stulpeliuose parodytas akumuliatoriaus, vandenilio ir benzino energijos kiekis. Matome, kad yra daug
Baterija:
- Energijos kiekis: 220Wh/kg, 360Wh/l
- Labai efektyvus
- Trumpas saugojimas
- Galimas tiesioginis energijos išleidimas
- Transportas sudėtingas
Vandenilis (700 barų):
- Energijos kiekis: 125.000 34,72 kJ/kg, XNUMX kWh/kg
- 30 % šilumos, 70 % H2 (PEM kuro elementas)
- Galimas ilgas saugojimas
- Būtinas konvertavimas
- Patogus transportui
Benzinas:
- Energinė vertė: 43.000 11,94 kJ/kg, XNUMX kWh/kh
- Grąžina iki 33 proc.
- Galimas ilgas saugojimas
- Būtinas pertvarkymas (deginimas)
- Patogus transportui
Vandenilis randamas visur aplink mus, bet niekada nėra laisvas. Jis visada surištas. Mes jį pagaminsime, izoliuosime ir sandėliuosime.
- 1 kg gryno vandenilio (H2) dujų = 11.200 XNUMX litrų esant atmosferos slėgiui
- H2 yra mažesnė nei bet kuri kita molekulė
- H2 yra lengvesnis už bet kurią kitą molekulę
- H2 visada ieško ryšių
Be vandenilio gamybos ir naudojimo lengvuosiuose automobiliuose, šiame puslapyje taip pat aptariamas jo saugojimas ir transportavimas (puslapio apačioje).
Vandenilio gamyba:
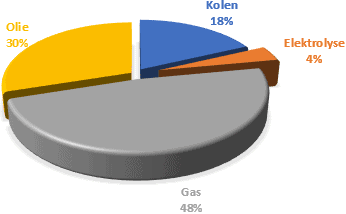
Vandenilis yra dujos, kurios nėra išgaunamos iš žemės, kaip ir gamtinės dujos. Turi būti gaminamas vandenilis. Tai, be kita ko, atliekama elektrolizės būdu, kurio metu vanduo paverčiamas vandeniliu ir deguonimi. Tai yra atvirkštinė reakcija, kuri vyksta kuro elemente. Be to, vandenilį galima gauti naudojant mažiau aplinkai nekenksmingus procesus. Žemiau pateikti duomenys rodo, kaip vandenilis gali būti gaminamas 2021 m.
- Akmens anglys: C + H20 -> CO2 + H2 + Nox + SO2 + … (temp.: 1300–1500 C)
- Gamtinės dujos: CH4 + H2O -> CO2 + 3H2 (reikalinga temperatūra: 700C-1100C)
- Aliejus: CxHyNzOaSb + …. -> cH2 + labai daug šalutinių produktų
- Elektrolizė iš vandens: 2H2O -> 2H2 + O2
Elektrolizė iš vandens yra labai švari ir yra ekologiškiausia vandenilio gamybos forma. Tai išskiria vandenilį ir deguonį, skirtingai nei perdirbant iškastinį kurą, dėl kurio išsiskiria CO2.
- Vandens elektrolizė; Elektrolizė yra cheminė reakcija, kurios metu vandens molekulės skaidomos ir susidaro grynas vandenilis ir deguonis. Vandenilį galima gaminti visur, kur yra vandens ir elektros. Trūkumas yra tas, kad norint pagaminti vandenilį ir vėl jį paversti elektra, reikia elektros energijos. Šio proceso metu prarandama iki 50 proc. Privalumas yra tas, kad energija kaupiama vandenilyje.
- iškastinio kuro konvertavimas; Naftoje ir dujose yra angliavandenilių molekulių, sudarytų iš anglies ir vandenilio. Vandenilį iš anglies galima atskirti naudojant vadinamąjį kuro procesorių. Trūkumas yra tas, kad anglis dingsta į orą kaip anglies dioksidas.
Vandenilio gamyba, gaunama naudojant iškastinį kurą, vadinama pilkuoju vandeniliu. Tai į atmosferą išskiria NOx ir CO2.
Nuo 2020 m. gamyba taps vis „mėlynesnė“: bus surenkamas CO2.
Siekiama iki 2030 m. gaminti tik ekologišką vandenilį: ekologiška elektra ir vanduo yra ekologiškiausio vandenilio generavimo šaltiniai.
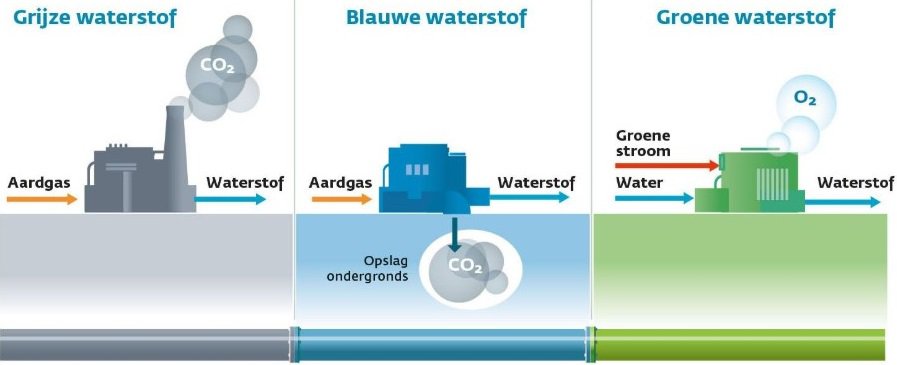
Chemijos pasaulyje vandenilis vadinamas H2, o tai reiškia, kad vandenilio molekulė susideda iš dviejų vandenilio atomų. H2 yra dujos, kurių gamtoje nėra. H2 molekulė yra visų rūšių medžiagose, iš kurių geriausiai žinomas vanduo (H20). Vandenilis turi būti gaunamas atskiriant vandenilio molekulę nuo, pavyzdžiui, vandens molekulės.
Todėl vandenilio gamyba elektrolizės būdu yra ateitis.
Toliau pateiktame paveikslėlyje parodytas modelis, dažniausiai naudojamas chemijos pamokose.
- Vandenyje kabo teigiami ir neigiami akumuliatoriaus strypai;
- Anodo pusėje jūs gaunate deguonies;
- Katodo pusėje gausite vandenilį.
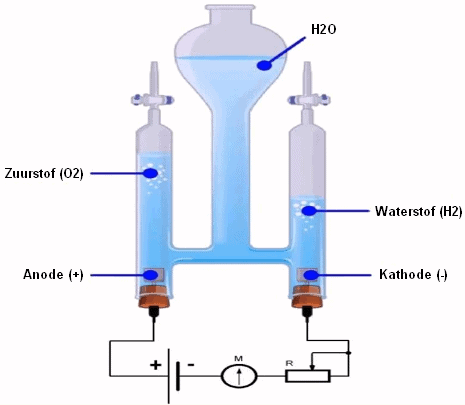
Vandenilis, pagamintas iš iškastinio kuro, pavyzdžiui, metano (CH4), šiuo atveju reformuojant paverčiamas H2 ir CO2. CO2 gali būti atskirtas ir saugomas po žeme, pavyzdžiui, tuščiame gamtinių dujų telkinyje. Todėl naudojant gamtines dujas į atmosferą išmetamas CO2 kiekis yra nedidelis arba jo nedaromas. Vandenilis taip pat gali būti pagamintas iš biomasės. Jei šio proceso metu išsiskiriantis CO2 taip pat yra atskiriamas ir saugomas po žeme, netgi įmanoma pasiekti neigiamą CO2 emisiją; CO2 pašalinimas iš atmosferos ir šio CO2 saugojimas Žemėje.
Vandenilis, skirtingai nei iškastinis kuras, pavyzdžiui, nafta, gamtinės dujos ir anglis, yra ne energijos šaltinis, o energijos nešiklis. Tai reiškia, kad pirmiausia reikia įdėti energiją, išsiskiriančią naudojant vandenilį, pavyzdžiui, kaip kurą automobilyje. Elektros energija reikalinga vandeniliui gaminti elektrolizės būdu. Tuomet šio vandenilio tvarumas labai priklauso nuo naudojamos elektros energijos tvarumo.
Vandenilis kaip kuras Otto varikliui:
Otto variklis yra kitas benzininio variklio pavadinimas. Benzininį variklį 1876 metais išrado Nikolausas Otto. Šiuo atveju tai vadiname Otto varikliu, nes benzinas pakeičiamas kitu kuru – vandeniliu. Variklyje, kuriame įpurškiamas vandenilis, nebėra degalų bako su benzinu.
Deginant vandenilį, nesusidaro CO2 dujos, skirtingai nei įprasti Otto ir dyzeliniai varikliai, o susidaro tik vanduo. Jei vandenilis įpurškiamas tiesioginiu įpurškimu, galia padidės 15–17%, palyginti su benzinu. Kai vandenilis įpurškiamas į įleidimo vožtuvą (netiesioginis įpurškimas), greitai įkaista per orą. Orą taip pat išstumia vandenilis. Abiem atvejais į degimo kamerą patenka mažiau deguonies (O2). Blogiausiu atveju galios nuostoliai siekia iki 50%.
Oro ir vandenilio santykis nėra toks tikslus kaip, pavyzdžiui, oro ir benzino mišinyje. Todėl degimo kameros forma nėra labai svarbi.
Vandenilį galima įpurkšti dviem būdais:
– Skystis: tiekiant skystį vandenilį, degimo temperatūra santykinai nukris dėl garavimo, todėl susidaro mažiau NOx.
– Dujinis: jei vandenilis rezervuare laikomas skystu ir jis teka į degimo erdvę esant aplinkos temperatūrai, vandenilį iš skysto į dujinę reikia naudoti garintuvu. Tokiu atveju garintuvas šildomas variklio aušinimo skysčiu. Galimos NOx mažinimo priemonės yra; taikant EGR, vandens įpurškimas arba žemesnė suspaudimo laipsnis.
Toliau pateiktame paveikslėlyje parodytos keturios situacijos su trimis skirtingomis vandenilio įpurškimo versijomis. Antrame paveikslėlyje iš kairės dujinis vandenilis netiesiogiai įpurškiamas į įsiurbimo kolektorių. Dujinis vandenilis kaitinamas aplinkos temperatūra. Vandenilis taip pat užima vietą, todėl į cilindrą patenka mažiau deguonies. Tai yra situacija, kai prarandama daugiausia galios.
Trečiame paveikslėlyje vandenilis tiekiamas skystu pavidalu. Kriogeninis reiškia, kad vandenilis buvo labai atšaldytas (didelio skysto vandenilio kiekio laikymo būdas santykinai mažoje talpykloje). Kadangi vandenilio temperatūra žemesnė ir jis yra skystos būsenos, balionas geriau užpildomas. Dėl žemos temperatūros pasiekiamas beveik toks pat efektyvumas kaip variklio su tiesioginiu (vandenilio) įpurškimu. Tiesioginio įpurškimo variklis matomas ketvirtame paveikslėlyje. Visa degimo erdvė užpildyta deguonimi. Kai įsiurbimo vožtuvas uždarytas ir stūmoklis suspaudžia orą, per purkštuką įpurškiamas tam tikras vandenilio kiekis. Šio variklio uždegimo žvakė yra už purkštuko arba šalia jo (tai nepavaizduota paveikslėlyje).
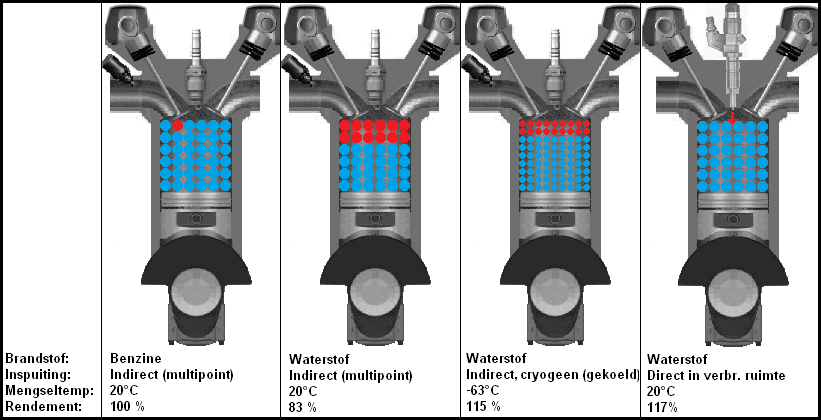
Otto variklio efektyvumas, žinoma, nėra 100%, tačiau šiame paveikslėlyje vandenilio degimo efektyvumas lyginamas su benzino degimu.
Vandenilio energijos tankis masės vienete yra didelis (120 MJ/kg), todėl jis beveik tris kartus didesnis nei benzino. Geros vandenilio uždegimo savybės leidžia variklį paleisti labai liesai, kai lambda reikšmė yra nuo 4 iki 5. Lieso mišinio naudojimo trūkumas yra tas, kad galia bus mažesnė ir važiavimo savybės. Norėdami tai kompensuoti, dažnai naudojamas kompresorius (turbo).
Dėl didesnio užsiliepsnojimo ploto, lyginant su benzininiais degalais, detonacijos ar atbulinio užsidegimo rizika yra didesnė. Todėl labai svarbu gerai valdyti degalų tiekimą ir uždegimą. Esant pilnai apkrovai, temperatūra degimo kameroje gali tapti labai aukšta. Dažnai būna vandens įpurškimas būtini, kad būtų užtikrintas pakankamas aušinimas ir taip būtų išvengta priešlaikinio užsiliepsnojimo (detonacijos ar atbulinės eigos pavidalu).
Kuro elementas:
Ankstesniame skyriuje buvo paaiškinta, kaip vandenilis gali būti naudojamas kaip kuras vidaus degimo varikliui. Kitas vandenilio panaudojimas yra kuro elemente. Transporto priemonė su kuro elementu turi ne vidaus degimo variklį, o vieną ar daugiau elektros variklių. Elektros energiją elektros varikliams valdyti gamina kuro elementas. Kuro elementas yra elektrocheminis įtaisas, kuris cheminę energiją tiesiogiai paverčia elektros energija, be šiluminių ar mechaninių nuostolių. Todėl energijos konversija kuro elemente yra labai efektyvi. Kuro elementas paprastai veikia vandeniliu, tačiau taip pat galima naudoti kurą, pvz., metanolį.
Kuro elementą iš principo galima palyginti su baterija, nes abu gamina elektros energiją cheminio proceso metu. Skirtumas tas, kad akumuliatoriuje sukaupta energija išleidžiama vieną kartą. Laikui bėgant energija baigiasi, todėl bateriją reikia įkrauti. Kuro elementas tiekia nuolatinę energiją, kol į elektrocheminį elementą tiekiami reagentai. Reagentai yra cheminės medžiagos, kurios reaguoja viena su kita cheminėje reakcijoje.
Kuro elemente vandenilis ir deguonis paverčiami H+ ir OH- jonais (įkrautomis dalelėmis). Atskirose kuro elemento kamerose jonai yra atskirti membrana. Kuro elemente yra du akytieji anglies elektrodai, ant kurių uždedamas katalizatorius; vandeniliui (H) – neigiamas elektrodas (anodas), o deguoniui (O) – teigiamas elektrodas (katodas).
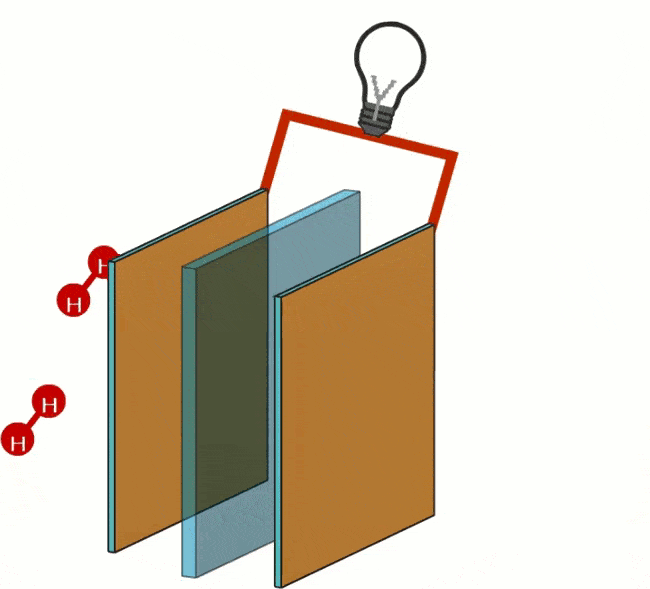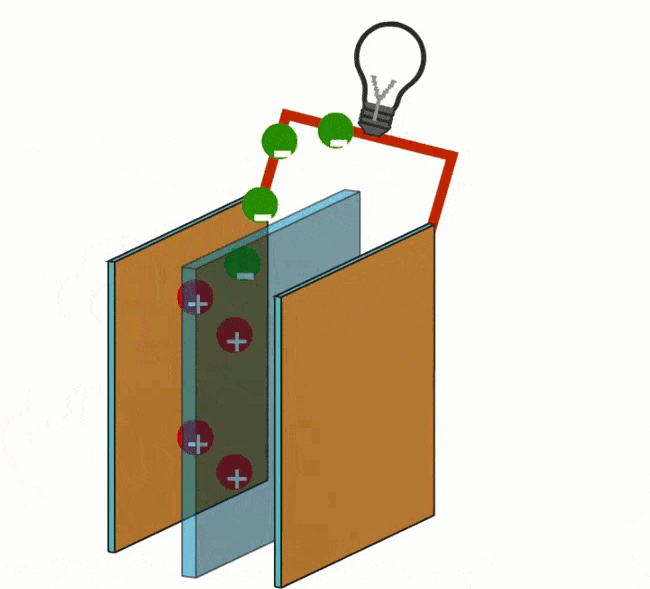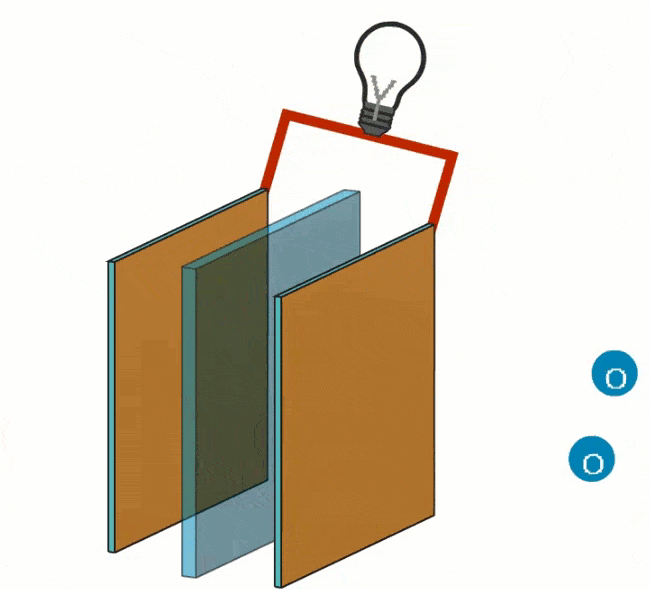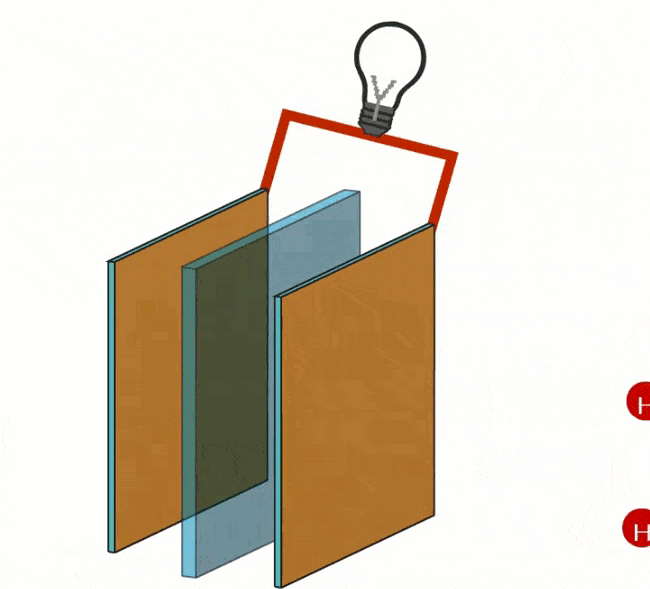
H+ ir OH- jonai yra vedami vienas prie kito per elektrodus (anodą ir katodą), po to + ir – jonai reaguoja vienas su kitu. Katodas katalizuoja reakciją, kurios metu elektronai ir protonai reaguoja su deguonimi, sudarydami antrąjį galutinį produktą, būtent vandenį. H+ ir OH- jonai kartu sudaro H2O molekulę. Ši molekulė nėra jonas, nes jos elektros krūvis yra neutralus. Pliusinė ir minusinė dalelė kartu sudaro neutralią dalelę.
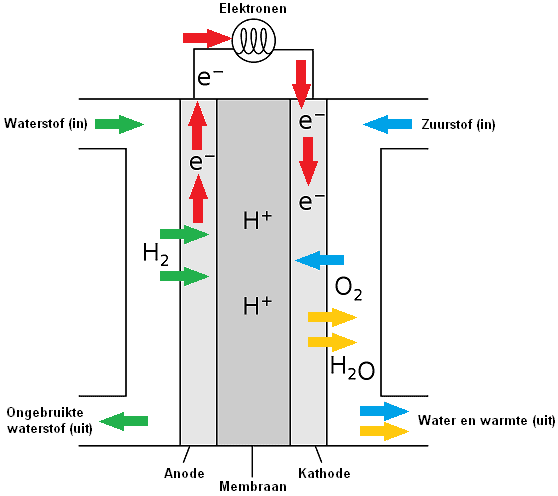
Vandenilio oksidacija (H) vyksta prie anodo. Oksidacija yra procesas, kurio metu molekulė atiduoda savo elektronus. Anodas veikia kaip katalizatorius, padalijantis vandenilį į protonus ir elektronus.
Redukcija vyksta prie katodo pridedant deguonies (O). Elektronai, užsandarinti anodu, pateks į katodą elektros laidu, jungiančiu elektronus aplink išorę.
Perkeliant elektronus ne tiesiogiai, o išoriniu keliu (srovės laidu), ši energija didžiąja dalimi išsiskiria kaip elektros energija. Grandinę uždaro jonai, esantys jungiančiame elektrolite tarp reduktoriaus ir oksidatoriaus.
Dalelė, sugerianti elektronus, vadinama oksidatoriumi ir dėl to redukuojama. Reduktorius praranda elektronus ir oksiduojasi. Redukcija yra procesas, kurio metu dalelė sugeria elektronus. Oksidacija ir redukcija visada vyksta kartu. Išleidžiamų ir sugertų elektronų skaičius visada yra vienodas.
Neigiamajame poliuje vyksta tokia reakcija:
Teigiamame poliuje vyksta kitokia reakcija:
Žemiau esančiame paveikslėlyje parodytas Toyota kuro elementų kamino vaizdas iš apačios. Šis kuro elementų kaminas yra po automobilio gaubtu. Prie šio kamino pritvirtintas elektros variklis. Elektros variklis tiekia maitinimą transmisijai, kuri yra prijungta prie pavaros velenų, kad perduotų varomąsias jėgas ratams.
Kamino viršuje matosi keli oro vamzdeliai. Tai, be kita ko, apima oro siurblį, kuris pumpuoja orą į kuro elementus, priklausomai nuo elektros variklio reikalingos galios.
Šis kuro elementų kaminas turi 370 kuro elementų. Kiekvienas kuro elementas tiekia 1 voltą, todėl iš viso į elektros variklį galima tiekti 370 voltų. Kuro elementai yra vienas po kito. Raudonas apskritimas rodo padidinimą, kuriame aiškiai matosi kuro elementų sudėjimas.

Sandėliavimo bakas:
Nors vandenilis turi didelį energijos tankį masės vienetui (120MJ/kg), todėl yra beveik tris kartus didesnis nei benzino, energijos tankis tūrio vienete yra labai mažas dėl mažesnės specifinės masės. Sandėliavimui tai reiškia, kad vandenilis turi būti laikomas esant slėgiui arba skystam, kad būtų galima naudoti reguliuojamo tūrio talpyklą. Yra du transporto priemonių pritaikymo variantai:
- Dujų laikymas 350 arba 700 barų slėgyje; Esant 350 barų slėgiui, bako tūris pagal energijos kiekį yra 10 kartų didesnis nei naudojant benziną.
- Skysčių laikymas -253 laipsnių temperatūroje (kriogeninė saugykla), kur bako tūris pagal energijos kiekį yra 4 kartus didesnis nei naudojant benziną. Naudojant dujinį saugojimą, vandenilis gali būti laikomas neribotą laiką neprarandant degalų ir nepakenkiant kokybei. Kita vertus, dėl kriogeninio saugojimo susidaro garai. Kadangi slėgis bake didėja dėl šildymo, vandenilis išbėgs per slėgio mažinimo vožtuvą; priimtinas maždaug dviejų procentų nuotėkis per dieną. Alternatyvios saugojimo galimybės vis dar tiriamos.
Žemiau esančiame paveikslėlyje pavaizduoti du saugojimo bakai po automobiliu. Tai yra rezervuarai, kuriuose vandenilis laikomas dujiniu pavidalu, esant 700 barų slėgiui. Šių talpyklų sienelių storis yra maždaug 40 milimetrų (4 centimetrų), todėl jos yra atsparios aukštam slėgiui.

Žemiau galite dar kartą pamatyti, kaip po automobiliu sumontuoti vandenilio bakai. Plastikinis vamzdis yra vandens nutekėjimas, susidarantis konvertuojant kuro elemente.

Degalų papildymas vandeniliu:
Šio straipsnio rašymo metu Nyderlanduose yra tik dvi vandenilio degalinės. Viena iš šių degalinių yra Rone (Pietų Olandija). Vaizduose pavaizduoti degalų papildymui naudojami pildymo purkštukai. Pripildymo darbinis slėgis yra 350 barų komercinėms transporto priemonėms ir 700 barų lengviesiems automobiliams.


Pripildymo jungtis automobilyje yra už įprasto kuro dangtelio. Pildymo pistoletas yra prijungtas prie šios užpildymo jungties. Prijungus užpildymo antgalį, jungtis užsifiksuos. Automobilio akumuliacinis bakas bus pripildytas 700 barų slėgio dujiniu vandeniliu.


Vandenilio diapazonas ir kaina
Kaip pavyzdį paimame „Toyota Mirai“ (2021 m. modelis) ir žiūrime į asortimentą bei papildomas išlaidas:
- Atstumas 650 km;
- Sąnaudos: 0,84 kg / 100 km;
- Kuro kaina už km: nuo 0,09 iki 13 centų;
- Kelių mokestis 0 €
Palyginti su transporto priemone su dyzeliniu varikliu, kuro elementų automobilis nėra pigus. Nors kelių mokesčių kaštai atlieka svarbų vaidmenį, 2021 m. Nyderlanduose degalinių vis dar yra nedaug. Žemiau pateikiamas 100 km sąnaudų palyginimas su dabartinėmis degalų kainomis:
BMW 320d (2012 m.)
- Dyzelinas: 1,30 € už litrą;
- Sąnaudos: 5,8 l/100 km;
- Kaina 100 km: 7,54 €.
„Toyota Mirai“ (2020 m.):
- Vandenilis: 10 € už kg;
- Sąnaudos: 0,84 kg/100km;
- Kaina 100 km: 8,40 €
Susiję puslapiai:
- Elektrinė pavara (Apžvalga);
- Energijos perėjimas.
