Themen:
- Einführung
- Zirkulärer Prozess
- Protokollieren Sie das pH-Diagramm
- Vergleichen Sie R134a mit R1234yf
Einführung:
Der Kühlprozess in der Klimaanlage eines Autos nutzt Veränderungen im Zustand eines Stoffes. Bei einer Zustandsänderung, etwa dem Übergang von Flüssigkeit zu Dampf, verändert sich die molekulare Struktur des Stoffes, was Wärme erfordert. Beim Übergang von Flüssigkeit in Dampf wird Wärme aufgenommen, im umgekehrten Fall, beim Übergang vom Dampf in die Flüssigkeit, wird Wärme abgegeben.
Wenn wir uns die Wärmeübertragung zur und von der Umgebung ansehen, sehen wir, dass sich die Umgebung beim Verdunstungsprozess abkühlt, während bei der Kondensation Wärme abgegeben wird und sich die Umgebung erwärmt. Diese Abkühlung der Umgebung erfolgt im Verdampfer, während die Erwärmung im Kondensator erfolgt. Dieser Vorgang wiederholt sich ständig, weshalb man ihn als Kreislaufprozess bezeichnet.
Auf der Seite „Einführung in die Klimatisierung“ wird der Kreislaufablauf mit den verschiedenen Komponenten der Klimatisierung praxisnah beschrieben. Auf dieser Seite werden wir anhand des logarithmischen pH-Diagramms näher auf diesen Zyklusprozess eingehen.
Recyclingprozess:
Bevor wir ein vollständiges logarithmisches pH-Diagramm zeigen, beginnen wir mit dem Prozess des Klimatisierungszyklus. In diesem Kreisprozess verwenden wir das Diagramm des Kältemittels R134a. In diesem Diagramm werden die Bereiche für Gas, Gas-Flüssigkeit und Flüssigkeit voneinander unterschieden. Der kritische Punkt liegt oben bei 101 Grad Celsius und einem Druck von 40 bar. Dies sind die maximale Temperatur und der maximale Druck, bei denen das Kältemittel chemisch stabil ist. Auf der x-Achse ist der Wärmeinhalt (Enthalpie) gegen den Druck aufgetragen. Obwohl wir es oft als „pH-Diagramm“ bezeichnen, handelt es sich aufgrund der logarithmischen Skalierung tatsächlich um ein „log-pH-Diagramm“.
- Bei Punkt 1 im Diagramm startet der Kompressor, der Kältemittel aus dem Verdampfer ansaugt. Der Druck beträgt 2 bar;
- Das Gas wird von 1 auf 2 komprimiert, wodurch sich Druck und Wärmegehalt erhöhen. Druck und Temperatur steigen auf 15 bar und 70 Grad Celsius. Das Gas ist überhitzt;
- Durch die Wärmefreisetzung im Kondensator sinkt der Wärmeinhalt und damit zunächst die Temperatur. Zwischen den Punkten 2 und 3 verliert das Gas seine Überhitzung, wodurch die Temperatur von 70 auf 55 sinkt ° C
- Von Punkt 3 bis 4 erfolgt eine Wärmeabgabe bei konstanter Temperatur. Hier wird das Gas in Flüssigkeit umgewandelt. Der Druck bleibt konstant;
- Bei weiterer Abkühlung wird die Flüssigkeit leicht unterkühlt (von 4 auf 5). Die unterkühlte Flüssigkeit erreicht unter dem hohen Druck von 15 bar eine Verengung an Punkt 5: der Kapillare oder dem Expansionsventil. Hier wird der Hochdruck vom Niederdruck getrennt. Vom Kompressor kann man auch sagen, dass der Förderdruck vom Saugdruck getrennt ist.
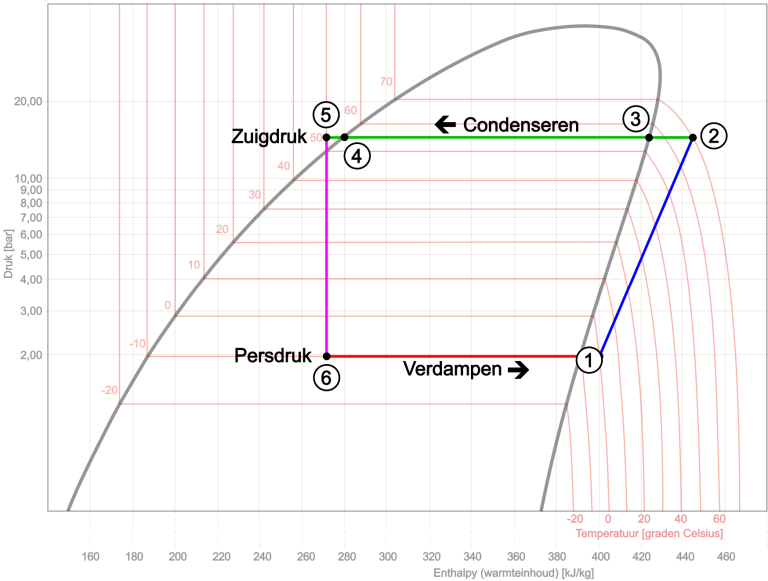
Durch den plötzlichen Druckabfall in der Verengung sinkt der Siedepunkt des Kältemittels in der flüssigen Phase, was zu einer spontanen Verdampfung führt. Die hierfür benötigte Wärme wird zunächst dem Kältemittel selbst und seiner Umgebung entzogen. Das bleibt bestehen der Wärmeinhalt ist nahezu konstant. Anschließend erfolgt die vollständige Verdampfung im Verdampfer von Punkt 6 nach 1. Die Siedetemperatur des Kältemittels sinkt zwischen den Punkten 5 und 6 von 50° C auf -10 °C und erwärmt sich schließlich auf Punkt 1 als Gas auf 0 °C. Der Wärmeinhalt des Kältemittels steigt, wobei die benötigte Wärme der Umgebung, in diesem Fall der durch den Verdampfer strömenden Luft, entzogen wird. Druck und Temperatur bleiben nahezu konstant. Das Kältemittel verlässt den Verdampfer als Dampf und wird am Punkt 1 vom Kompressor wieder angesaugt. Der Vorgang wiederholt sich.
Log-pH-Diagramm:
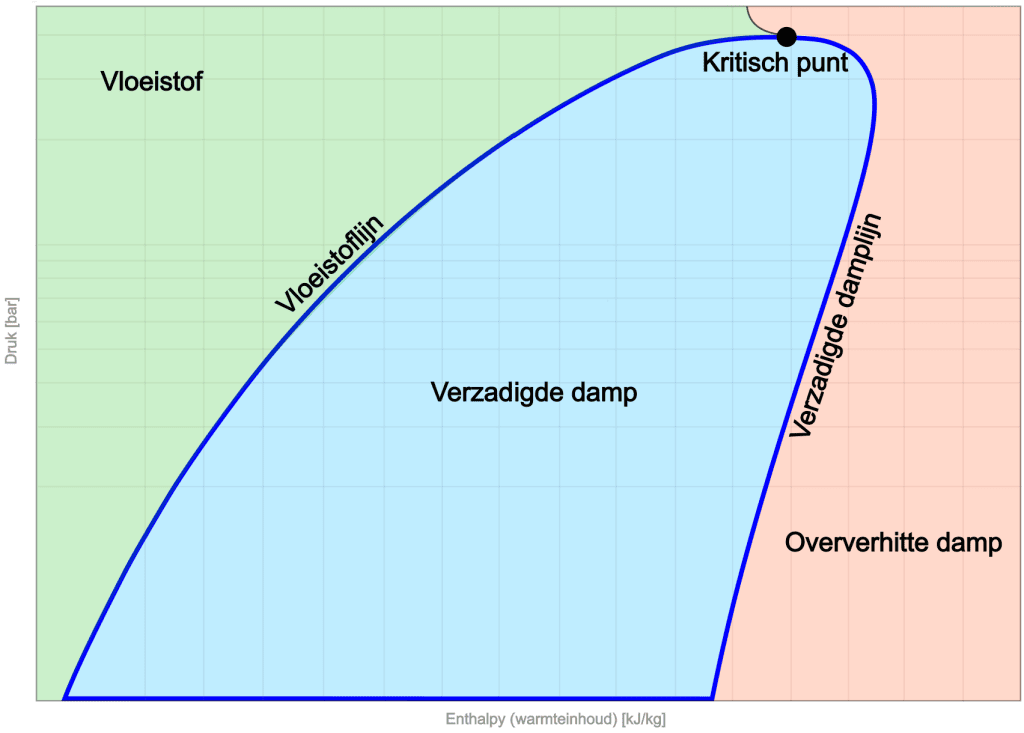
Im vorherigen Abschnitt wurde das logarithmische pH-Diagramm gezeigt, das den Kreislaufprozess (von der Verdampfung bis zur Kondensation des Kältemittels) zeigt. Das Bild unten zeigt den Zustand des Kältemittels bei einem bestimmten Druck im Verhältnis zur Enthalpie (Wärmeinhalt), wobei der Kreisprozess durch die dunkelblaue Linie angezeigt wird.
Auf der linken Seite des Diagramms befindet sich der Flüssigkeitsbereich. Bei niedriger Enthalpie liegt das Kältemittel in flüssiger Form vor. Mit zunehmender Enthalpie wird die Flüssigkeitslinie erreicht. Die Steigung dieser Linie gibt die Druck- und Enthalpieänderungen für die flüssige Phase an.
In der Mitte des Diagramms befindet sich die gesättigte Dampfzone. Hier befindet sich das Kältemittel im thermischen Gleichgewicht, wobei sowohl Flüssigkeit als auch Dampf vorhanden sind.
Rechts sehen wir die Sattdampflinie, die die Grenze markiert, bei der das Kältemittel vollständig verdampft ist und sich in einer überhitzten Dampfphase befindet.
Oben im Diagramm befindet sich der kritische Punkt, der die Grenze zwischen Flüssigkeit und Dampf markiert. Hier verschwindet die Unterscheidung zwischen Dampf- und Flüssigphase und das Kältemittel verbleibt in einem einzigartigen Zustand. Es gibt keinen klaren Übergang zwischen Flüssigkeit und Dampf.
Um einen besseren Einblick in das Log-pH-Diagramm zu erhalten, werden dem Diagramm unten mehrere Kurven hinzugefügt: die isentrope, isotherme, isochore und Dampfqualität. In der Zeichnung unten sehen wir noch einmal den Kreisprozess (grau eingefärbt) mit dem Verlauf der anderen Prozesse. Hier ist eine kurze Erklärung jeder Zustandsänderung:
Isentropisch: Die isentropische Linie zeichnet sich durch konstante Entropie aus. Das bedeutet, dass das Kältemittel während eines Prozesses entlang dieser Linie keinen Wärmeaustausch mit der Umgebung hat und keine Entropieänderung erfährt. Im Diagramm handelt es sich um eine effiziente adiabatische Prozesslinie (ohne Wärmeaustausch).
Isotherme: Eine isotherme Linie im log-pH-Diagramm stellt einen Prozess mit konstanter Temperatur dar. Während dieses Prozesses bleibt die Temperatur des Kältemittels konstant, was bedeutet, dass Wärme zugeführt oder abgeführt wird, um das Druck-Enthalpie-Verhältnis (ph) konstant zu halten.
Isochore: Eine isochore Linie im log-pH-Diagramm stellt einen Prozess mit konstantem Volumen dar. Dabei bleibt das spezifische Volumen des Kältemittels konstant, es kommt also zu keiner Volumenänderung. Dadurch kann sich der Linienstil abhängig von anderen Änderungen wie Druck und Enthalpie im Diagramm nach oben oder unten bewegen.
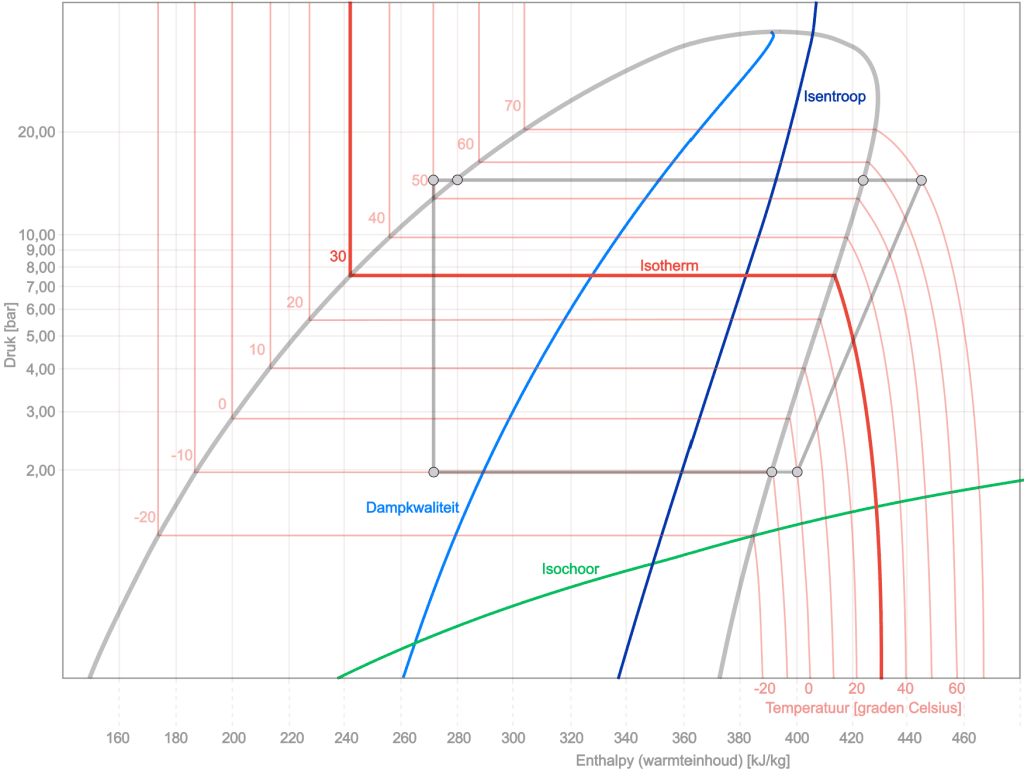
- Dampfqualität: In einem Protokoll-pH-Diagramm eines Kältemittels zeigt die x-Achse den Qualitätsbereich an, von „x=0“ (vollständig flüssig) bis „x=1“ (vollständig gasförmig). Zwischen diesen Extremen befindet sich das Kältemittel in einem zweiphasigen Zustand, wobei der x-Wert das Verhältnis von Gas zu Flüssigkeit angibt. Eine Linie von „x=0,10“ bis „x=0,90“ im Diagramm zeigt an, dass sich das Kältemittel in diesem Zweiphasenbereich befindet, wobei der spezifische x-Wert die Gas-/Flüssigkeitsverteilung angibt. Dies ist entscheidend für das Verständnis des Verhaltens des Kältemittels in Anwendungen wie Kühl- und Klimaanlagen.
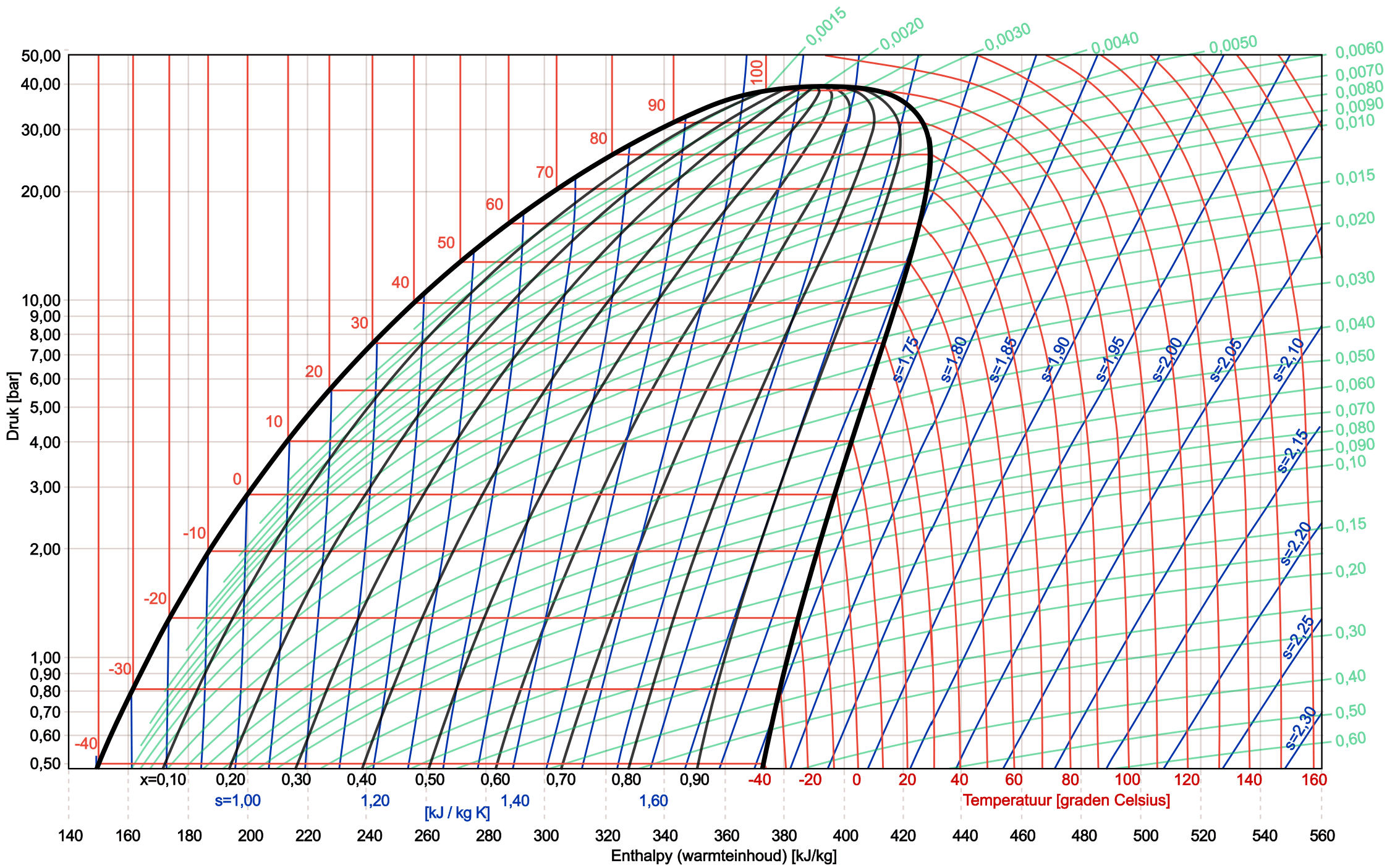
Im Bild unten sehen wir ein vollständiges logarithmisches pH-Diagramm des Kältemittels R134a.
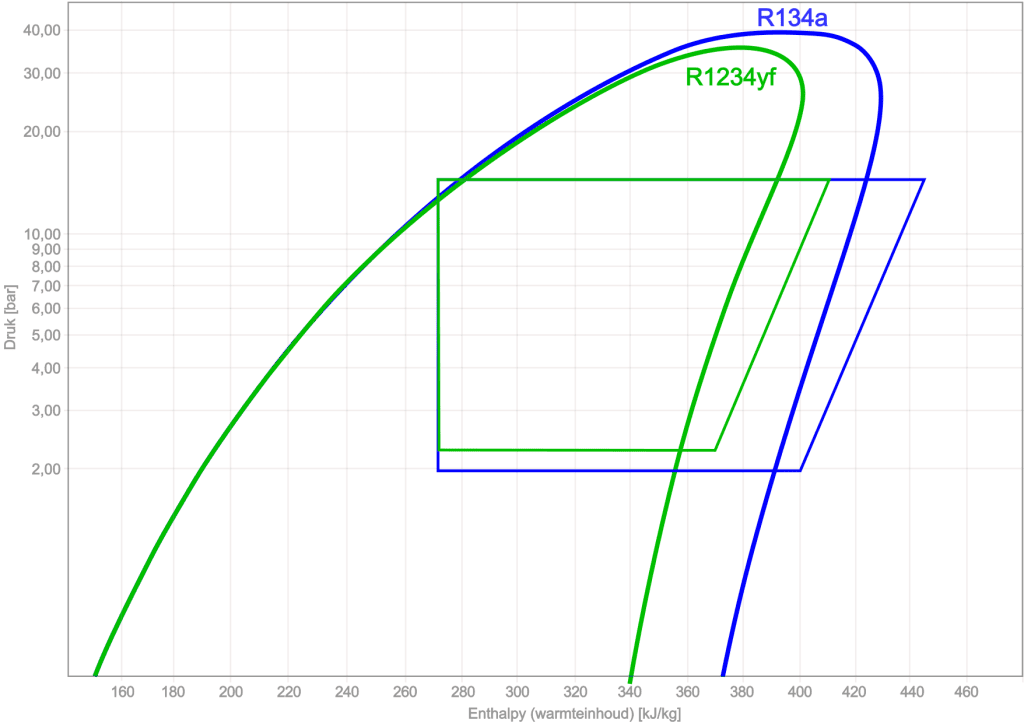
Vergleichen Sie R134a mit R1234yf:
Mithilfe des logarithmischen pH-Diagramms können verschiedene Arten von Kältemitteln miteinander verglichen werden. Die folgende Abbildung zeigt die logarithmischen pH-Diagramme und Zyklenprozesse von R134a und R1234yf.
Verwandte Seite:
