Tema:
- Corrosión y óxido
- Combatir el óxido
- Prevenir el óxido
- Corrosión por picadura
- Corrosión por contacto
Corrosión y oxidación:
Los conceptos de corrosión y herrumbre están estrechamente relacionados. El óxido es el resultado de la corrosión. Sin embargo, estos dos conceptos suelen utilizarse indistintamente.
- La corrosión es un término general para el deterioro de materiales a través de reacciones (químicas) con su entorno;
- La oxidación se produce en la superficie del hierro o el acero como resultado del contacto con el agua y el oxígeno. El óxido se refiere a la oxidación del hierro, que también es una forma de corrosión.
Tan pronto como los metales se exponen a la atmósfera normal (el aire exterior), este metal formará un enlace químico con el oxígeno. En este caso, el metal se oxidará. El óxido se puede reconocer por la capa de color marrón rojizo que aparece sobre el metal y que se crea cuando el hierro reacciona con el oxígeno, en presencia de humedad del aire exterior o de agua. Es una mezcla de óxido de hierro e hidróxido de hierro. El óxido continúa desarrollándose y puede corroer completamente el metal. Con el tiempo, todo el hierro se convierte en óxido y pierde así sus propiedades beneficiosas.
En caso de que el hierro esté expuesto al oxígeno y al agua, con el tiempo el oxígeno y el hierro se unirán a nivel atómico. Esto crea un nuevo compuesto: el óxido de hierro. El agua acelera todo el proceso porque actúa como catalizador. Las pequeñas moléculas de agua penetran en el metal y forman aún más ácidos, lo que expone aún más el metal a la formación de óxido. La oxidación ocurre aún más rápido en el agua de mar debido a la mayor concentración de iones de cloruro de sodio.
Pueden aparecer manchas de óxido debajo de la pintura del coche. Esto se debe a que el barniz también es más o menos poroso y, por tanto, puede dejar pasar la humedad y el oxígeno. Para mantener sellada la capa de pintura, es bueno encerar el coche con regularidad. Especialmente en invierno, con mucha humedad y salmuera, esta última es una buena forma de prevenir la oxidación en la medida de lo posible.
Si hay rayones profundos o astillas de piedra, la capa protectora de pintura en esta área desaparecerá y el área circundante también puede comenzar a oxidarse. Por lo tanto, es aconsejable retocar estas manchas lo antes posible con un rotulador o volver a pintarlas.
En la imagen de abajo vemos un VW Escarabajo con partes de la carrocería oxidadas. Este vehículo pertenece a la rúbrica "Rat rod". Los vehículos que han sido convertidos a Rad Rot se componen de piezas deliberadamente desgastadas y sin pintar (en este caso óxido) y piezas desechadas.

En muy pocos casos se puede apreciar oxidación. Sin embargo, todos los vehículos tendrán que afrontarlo tarde o temprano. Además del clima húmedo de los Países Bajos, la salmuera de la calzada conlleva un mayor riesgo de oxidación en invierno. Además de las piezas estéticas, también pueden verse afectadas partes del chasis o de la carrocería. A largo plazo, esto puede dar lugar a un vehículo inseguro y al rechazo durante la ITV.
Los fabricantes de automóviles intentan que los materiales dentro y alrededor del automóvil sean lo más resistentes posible a la oxidación. Estos son algunos de los tratamientos antioxidantes:
- galvanizar la carrocería;
- aplicar tratamientos de cera;
- aplicar capas de imprimación y capa base;
- aplicar capas de laca de alta calidad.



Combatir el óxido:
El óxido es causado por la combinación del hierro con el oxígeno. Es incorrecto pensar que se puede combatir el óxido garantizando que no llegue más oxígeno al hierro. El acero no es una sustancia homogénea, sino una mezcla de materiales que se reúnen durante el reciclaje, por ejemplo, restos de coches viejos. El acero también contiene otros metales. Existe una pequeña diferencia de voltaje entre los cristales de dos materiales diferentes, en la que un líquido conductor puede asegurar el contacto entre los cristales. La corriente eléctrica resultante asegura que el metal menos noble se disuelva. Por ejemplo, si fluye una corriente entre el hierro y el cobre, el hierro se disuelve. Las partículas de hierro disueltas se combinan con el oxígeno. Con la menor cantidad de agua en la capa del cuerpo, aunque sea solo una molécula de agua, el proceso se mantiene.
Si sufre óxido debajo de la pintura, no tiene sentido rociar sobre el óxido. El óxido continúa carcomiendo bajo la capa de pintura sin cesar. Debido a que el volumen de la roca es mayor que el del acero, la capa de pintura eventualmente se agrietará. Esto crea una abertura por donde puede penetrar más agua y acelerar el proceso de oxidación. Para combatir la oxidación, el acero se desoxida mediante granallado de la superficie. A continuación se aplica lo más rápido posible una capa de imprimación resistente a la oxidación. No espere demasiado para hacerlo, de lo contrario la humedad del aire exterior se adherirá a las partículas de hierro.

Se forma óxido debajo de la capa de pintura. Por lo tanto, el óxido incipiente no siempre es fácil de reconocer. Las cuatro imágenes siguientes muestran una viga rectangular de un VW Golf IV donde se ha eliminado el metal oxidado. Antes de empezar los trabajos, en el borde debajo del umbral sólo había betún suelto. Las vigas cajón no presentaban irregularidades. Cuando se eliminó el betún, los bordes marrones se hicieron visibles. El metal que lo rodeaba ya estaba corroído hasta tal punto que se rompía fácilmente. Las fotografías muestran cómo puede comportarse el óxido bajo el betún.




Prevenir la oxidación:
En el primer párrafo se mencionaba “galvanizar” en el resumen de medidas para evitar la oxidación. Los fabricantes aplican una fina capa de zinc durante la producción del automóvil. Esto proporciona la llamada protección catódica. Debido a que es más probable que los electrones escapen del zinc, el zinc se disuelve antes que el hierro. El zinc se une más fácilmente al oxígeno del aire. El zinc es bastante duro y forma una capa selladora. Si el acero se raya profundamente a través de la pintura y la capa de zinc, el acero difícilmente reaccionará. Si hay suficiente zinc cerca, la corriente eléctrica fluirá en la dirección correcta. Por este motivo, el zinc ofrece protección a largo plazo contra la corrosión y el óxido.

El acero galvanizado no sólo tiene ventajas. A medida que ésta aumenta, la cantidad de acero puro disminuye. Los fabricantes necesitan acero sin zinc, entre otras cosas, para fabricar piezas de motores. El zinc tiene la propiedad de formar burbujas en el acero, lo que produce puntos débiles.
Corrosión por picadura:
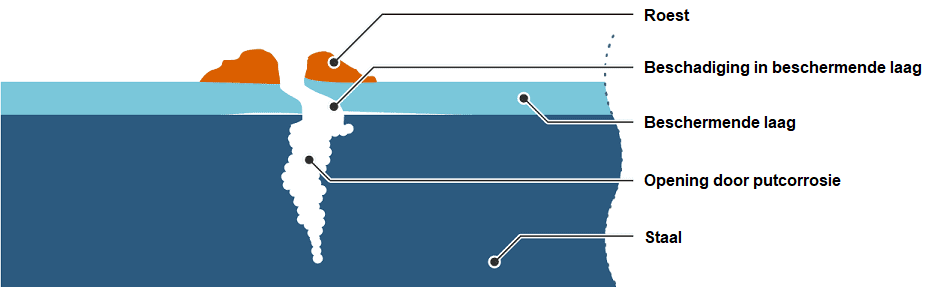
Las picaduras son un ataque local a la superficie del material. La corrosión por picaduras se produce en materiales que se protegen contra la corrosión con una capa de óxido y se produce principalmente cuando esta capa de óxido está dañada. La corrosión por picaduras corroe rápida y profundamente el material. Esto es lo más peligroso, porque aparentemente el material todavía tiene buen aspecto y la profundidad de la corrosión no es suficientemente visible.
La siguiente imagen muestra la sección transversal de un objeto de acero con corrosión por picaduras. En la parte superior sólo se ve una pequeña cantidad de óxido. El “hoyo” en el óxido revela la abertura que ha aparecido en el acero.
Podemos encontrar corrosión por picaduras en las líneas de freno, entre otras cosas. Cuando la abertura se vuelve más profunda, existe la posibilidad de que se escape el líquido de frenos.

Corrosión por contacto:
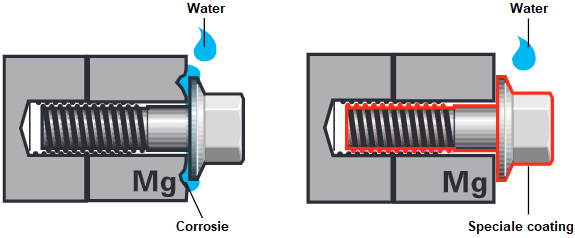
Esto ocurre cuando dos metales diferentes entran en estrecho contacto entre sí. Se genera una diferencia de voltaje entre estos dos metales, provocando una reacción. Esto lo vemos, por ejemplo, cuando se atornilla un tornillo de acero inoxidable a una chapa de acero galvanizado. El metal más noble favorece la corrosión y, por tanto, la oxidación. Esto se llama corrosión por contacto.
La siguiente imagen muestra dos ejemplos de un componente de magnesio, por ejemplo una caja de cambios, que se fija con un perno de una aleación de hierro. Si la superficie de contacto se expone al agua, se crea una corriente eléctrica entre los dos metales que provoca corrosión en el contacto. Al mismo tiempo, se descompone el magnesio. La corrosión por contacto se puede prevenir inhibiendo la corriente eléctrica entre los dos metales recubriendo el perno con una capa no conductora y, por lo tanto, aislante.
La siguiente tabla muestra las diferentes combinaciones de materiales (por ejemplo, piezas del motor o la carcasa de la caja de cambios) y cómo la elección de los materiales para el perno o el tornillo afecta a la corrosión por contacto.

